เทคนิคการคัดแยก เพศลูกสัตว์
เทคนิคการคัดแยก เพศลูกสัตว์
โดย : อาจารย์ ดร.ฉัตรชัย จันทร์สมบูรณ์ ภาควิชาสัตวบาล คณะเกษตร กำแพงแสนมหาวิทยาลัยเกษตรศาสตร์ Fagrccc@ku.ac.th
ระบบการเลี้ยงสัตว์ในปัจจุบันพบว่า การพัฒนาระบบการผสมพันธุ์โดยอาศัยวิธีการผสมเทียมเข้าช่วย มีความจำเป็นอย่างยิ่งต่อการเลี้ยงสัตว์ เนื่องจากการผสมเทียมสามารถเพิ่มผลผลิต และกระจายพันธุกรรมที่ดีของพ่อพันธุ์ไปสู่รุ่นลูกได้ดีกว่า และมากกว่าการผสมแบบธรรมชาติ อย่างไรก็ตามการผสมเทียมอาจให้ผลเกินความต้องการในบางกรณี ตัวอย่างเช่น ในการเลี้ยงโคนมต้องการลูกเพศเมียมากกว่าลูกเพศผู้ แต่ในการเลี้ยงโคเนื้อกลับต้องการลูกเพศผู้มากกว่าเพศเมีย ในสุกรก็เช่นกันต้องการลูกเพศเมียพันธุ์ลาร์จไวท์ หรือแลนด์เรซ มากกว่าลูกเพศผู้เพื่อใช้ เป็นสายแม่พันธุ์ในการผลิตลูกผสม 2 สายพันธุ์ หรือถ้าเลี้ยงเป็นสุกรขุนเพศเมียก็ไม่จำเป็นต้องตอน ทำให้คุณภาพซากดีกว่าเพศผู้ตอน ในขณะเดียวกันกลับต้องการลูกสุกรเพศผู้พันธุ์ดูรอคมากกว่าเพศเมีย เพื่อใช้เป็นพ่อพันธุ์ในการผลิตลูกผสม 3 สายพันธุ์ เป็นต้น จะเห็นได้ว่าถ้าหากสามารถกำหนดเพศของลูก ที่จะเกิดมาได้ก็จะสามารถพัฒนาการเลี้ยงสัตว์ไปได้อย่างรวดเร็ว การกำหนดเพศของลูกสัตว์ให้ได้ตามความต้องการนั้น สามารถกำหนดได้ใน 2 ระยะคือ การกำหนดเพศก่อนการปฏิสนธิ และการกำหนดเพศภายหลังการปฏิสนธิ แต่การกำหนดเพศหลังจากปฏิสนธินั้นกระทำได้ยากกว่า เพราะต้องผ่านขบวนการหลายขั้นตอนอาจจะทำให้ตัวอ่อนฟกซ้ำได้นอกจากนี้การย้ายฝากตัวอ่อนที่แยกเพศแล้วนั้น เป็นการเสี่ยงต่อการติดเชื้อด้วย ดังนั้นการกำหนดเพศของลูกโดยวิธีการแยกเพศของอสุจิก่อนดูเหมือนจะเป็นวิธีที่ง่ายและสะดวกมากกว่า การคัดแยกเพศของอสุจิจะอาศัยหลักการของความแตกต่างกันระหว่างอสุจิ X และอสุจิ Y มาพัฒนาวิธีการต่างๆ ซึ่งความแตกต่างนี้ได้แก่ น้ำหนัก, ขนาด, รูปร่าง, การเคลื่อนที่, ลักษณะประจุไฟฟ้าบนพื้นผิว, ลักษณะของ antigen บนพื้นผิวของอสุจิ, DNA ที่เป็นองค์ประกอบ และความทนทานต่อสารเคมีหรือการเปลี่ยนแปลงสภาพความเป็น กรด-ด่าง แต่ความแตกต่างเหล่านี้มีน้อยมาก ทำให้มีวิธีการคัดแยกที่แตกต่างกันไปมากมาย แต่ว่าการคัดแยกเพศของอสุจินั้นยังมีความยุ่งยากซับซ้อน จำเป็นต้องอาศัยเครื่องมือและวิธีการที่แม่นยำและเชื่อถือได้ อีกทั้งสารเคมีที่ใช้ต้องเหมาะสม และไม่มีผลกระทบต่ออสุจิด้วย ดังนั้นวิธีการคัดแยกเพศของอสุจิจึงยังเป็นเพียงวิธีการที่กระทำอยู่แต่ในห้องปฏิบัติการทางวิทยาศาสตร์เท่านั้น อย่างไรก็ตามเมื่อเปรียบเทียบวิธีการต่างๆ แล้วพบว่าการคัดแยกเพศด้วยวิธีการปั่นเหวี่ยงมีข้อได้เปรียบคืออาศัยเครื่องมือ และสารเคมีที่ไม่ซับซ้อนนัก อีกทั้งหลักการก็ไม่ยุ่งยากต่อการเข้าใจและไม่สิ้นเปลืองเวลา ซึ่งจำเป็นมากต่อการนำไปเผยแพร่ถ่ายทอดสู่เกษตรกรผู้เลี้ยงสุกร และอาจรวมไปถึงเป็นแนวทางที่จะประยุกต์ใช้ในสัตว์เลี้ยงชนิดอื่นต่อไป

การกำหนดเพศโดยการตรวจสอบเพศของลูกสัตว์ (การคัดแยกเพศหลังการปฏิสนธิ)
Cytogenetic analysis เป็นการตรวจสอบโครโมโซมของตัวอ่อน เป็นวิธีการที่มีความแม่นยำสูง โดยการวิเคราะห์รูปแบบการเรียงตัวของโครโมโซม กล่าวคือเมื่ออสุจิเจาะผ่านชั้น Zoanpellucida ก็จะเริ่มมีการคลายตัวของโครโมโซม และจะเข้าสู่ระยะ Metaphase จากนั้นนำรูปแบบโครโมโซมในระยะ Metaphase มาวิเคราะห์หาโครโมโซมเพศ ว่าเป็นโครโมโซม Y หรือโครโมโซม X แต่วิธีการนี้ต้องการความละเอียดและใช้เวลามาก เนื่องจากต้องรอเวลาในการคลายตัวของโครโมโซมหลังจากที่เจาะผ่าน Zonafreehamseregg และต้องรอให้โครโมโซมเข้าสู่ระยะ Metaphase แล้วจึงจะนำรูปแบบของโครโมโซมมาวิเคราะห์ได้
Assay of X-linked enzymes, เป็นการตรวจสอบการทำงานของโครโมโซม X ด้วยการเปรียบเทียบปริมาณของเอนไซม์ Glocose-6-phosphate dehydrogenase (G6PD), เอนไซม์ Hypoxanthine guanine phosphoribo syltransterase (HPRT) และเอนไซม์ Phosphoglycerate kinase ซึ่งปริมาณของเอนไซม์เหล่านี้จะมีความเข้มข้นในเพศเมียมกกว่าประมาณ 2 เท่า เมื่อเทียบกับเพศผู้เนื่องจากในเพศเมียจะมีโครโมโซม X เป็นองค์ประกอบ 2 ชุด ในขณะที่เพศผู้จะมีโครโมโซม X เป็นองค์ประกอบเพียงชุดเดียว
Male-specific antigens, เป็นการตรวจหาสาร H-Y antigen ที่ผิวเซลล์ของอสุจิ Y โดยใช้สาร Antibody เฉพาะที่มีสารเรืองแสง (Fluoresense dye) จากนั้นตรวจสอบโดยการส่องดูในกล้องจุลทรรศน์เรืองแสงฟลูออเลสเซนต์
Y-chromosome specific DNA probes เป็นการตรวจสอบหาโครโมโซม Y โดยการนำเอาเนื้อเยื่อของตัวอ่อนบางส่วนมาสกัด DNA และทำการย้อมสารรังสีเฉพาะต่อโครโมโซม Y แล้วจึงตรวจสอบปริมาณรังสีที่แผ่ออกมา หากพบว่ามีการแผ่รังสีก็จะบ่งบอกว่าเป็นเพศผู้
PCR Method specific Y-chromosome เป็นการเพิ่มจำนวนของลำดับเบสบางส่วนที่เป็นองค์ประกอบบนโครโมโซม Y ด้วยกระบวนการ Polymerase chain reaction (PCR) ซึ่งวิธีการนี้มีความแม่นยำสูง แต่ต้องการผู้เชี่ยวชาญและเวลาในการดำเนินขบวนการในห้องปฏิบัติการ (Herr etal., 1990)
การกำหนดเพศ โดยวิธีการคัดแยกอสุจิ X และอสุจิ Y (การคัดแยกเพศก่อนการปฏิสนธิ)
อาศัยความแตกต่างของอสุจิ X และอสุจิ Y มาพัฒนาวิธีการคัดแยกวิธีต่างๆ พอจะแบ่งพิจารณาเป็นกลุ่มได้ดังนี้
พิจารณาจากน้ำหนัก ขนาดหรือรูปร่างของอสุจิ
การคัดแยกอสุจิ โดยอาศัยความแตกต่างในเรื่องน้ำหนักที่อสุจิ X หนักกว่าอสุจิ Y ถูกนำมาใช้เป็นหลักการคัดแยกอสุจิด้วยวิธี density gradient centrifugation ซึ่งอาศัยแรงเหวี่ยงจากการปั่น ทำให้อสุจิที่หนักกว่า (อสุจิ X) ตกลงกันหลอดเร็วกว่าอสุจิที่เบา (อสุจิ Y) ยิ่งเมื่อตกผ่านไปในสารละลายต่างระดับความหนาแน่นที่เพิ่มขึ้นที่ละน้อยจะทำให้มีประสิทธิภาพในการแยกเพิ่มขึ้น Rohdeet al. (1975) พบว่าอสุจิ X ตกตะกอนได้เร็วกว่าอสุจิ Y ในการปั่นแยกอสุจิในสารละลายซูโครสที่มีความเข้มข้นแตกต่างกัน แต่ผลของการแยกยังไม่สมบูรณ์นัก สารละลาย Percoll ดูเหมือนจะใช้กันอย่างแพร่หลายในวิธี Density gradient centrifugation เพราะมีคุณสมบัติที่ Osmolarity ไม่เปลี่ยนแปลงในความเข้มข้นที่แตกต่างกัน สารละลาย Percoll เป็นสารพวก Silicagel ที่อยู่ในรูปของสารละลาย ซึ่งถูกเคลือบด้วยสาร Polyvinyl pyrollidone และอยู่ในลักษณะของคอลอยด์ (McEvoy, 1992)
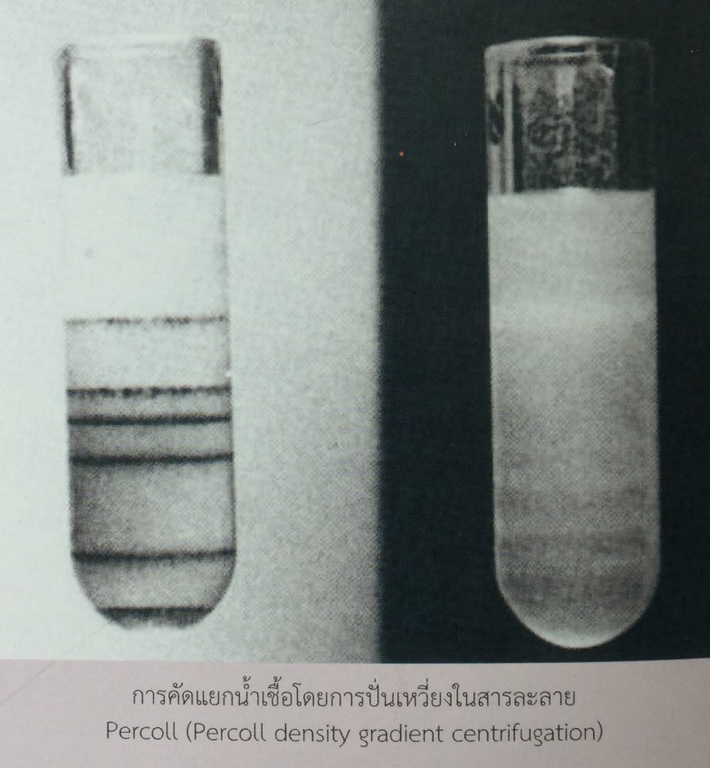
จากรายงานของ Mohriet al. (1987) พบว่าการปั่นแยกอสุจิที่ 250 g เป็นเวลา 30 นาที ให้ผลการแยกอสุจิ X และอสุจิ Y ดีที่สุด และสามารถแยกอสุจิได้ประมาณ 95 เปอร์เซ็นต์ เนื่องจากพบอสุจิที่แสดงลักษณะ F-body มีเพียง 6.4+1.8 เปอร์เซ็นต์ ของอสุจิที่ตกตะกอน ซึ่ง Othaniet al. (1988) ได้ใช้วิธี Percolldesity gradient centrifugation เพื่อจะแยกอสุจิ X และอสุจิ Y ของสุกรโดยแบ่งความเข้มข้นของสารละลาย Percoll ออกเป็น 7 ส่วน ส่วนล่างจะมีความเข้มข้นสูงที่สุด หลังทำการปั่นแยกและตรวจสอบอสุจิที่ปั่นแยกโดยวิธี F-body ผลปรากฏว่าอสุจิจากชั้นกลางของหลอดจะแสดงลักษณะ F-body ในช่วง 39.7 ถึง 55.1 เปอร์เซ็นต์ (เฉลี่ย 48.98+5.6 เปอร์เซ็นต์) เป็นสัดส่วนที่มากที่สุด และพบว่าอสุจิจากส่วนล่างของหลอดจะแสดงลักษณะ F-body เพียง 7.6 ถึง 13.7 เปอร์เซ็นต์ (เฉลี่ย 10.1+2.1 เปอร์เซ็นต์) ในโคเมื่อนำอสุจิจากส่วนล่างไปผสมเทียมพบว่าได้ลูกเพศเมีย 64 เปอร์เซ็นต์ (Mohriet.al., 1987)
พิจารณาจากคุณสมบัติทางประจุไฟฟ้าที่พื้นผิวของอสุจิ
อาศัยความแตกต่างจองประจุลบผิวอสุจิ X ที่มากกว่าอสุจิ Y ประจุลบที่พบนี้เกิดจากสารไกลโคโปรตีนพวก Sialicacid นำมาซึ่งการแยกอสุจิด้วยวิธี Electrophoresis เป็นผลทำให้อสุจิ X วิ่งเข้าหาขั้วบวกในขณะที่อสุจิ Y วิ่งเข้าหาขั้วลบ (Kaneko et al., 1984) ขณะเดียวกันน้ำหนักของอสุจิที่หนักกว่าก็มีส่วนช่วยให้ตกลงเร็วกว่าอสุจิที่มีน้ำหนักเบาโดยอาศัยเครื่อง Free-flow electrophoresis ที่มีขั้วบวก-ลบเป็นตัวคอยเหนี่ยวนำ ดึง และผลักให้อสุจิ X และอสุจิ Y แยกห่างออกจากกันไปยังคนละขั้วไฟฟ้า พบว่า 83-89 เปอร์เซ็นต์ของอสุจิคนที่พบที่ขั้วลบจะแสดงลักษณะ F-body ออกมาในเปอร์เซ็นต์สูง (Mohriet al., 1987)
พิจารณาจาก DNA ที่เป็นองค์ประกอบ
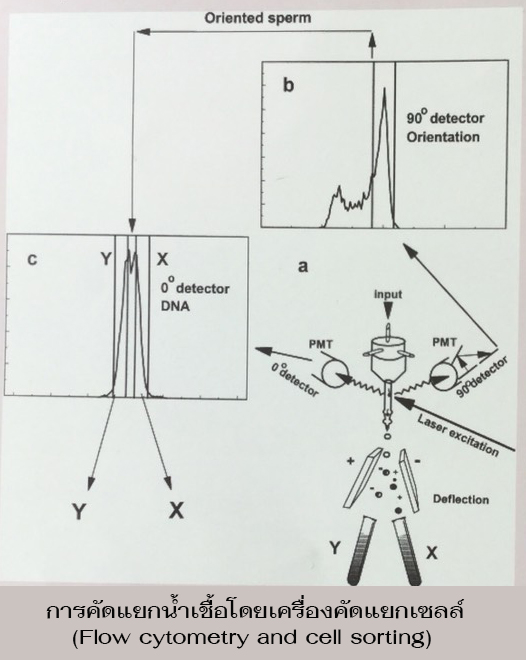
วิธีการแยกโดยอาศัยความแตกต่างของ DNA ที่เป็นองค์ประกอบ คือ Flow-cytomerty and cell sorting เป็นการวัด DNA ที่เป็นองค์ประกอบในอสุจิแต่ละเซลล์ วิธีการต้องมีการแยกอสุจิ ออกจากน้ำเชื้อ จากนั้นทำการย้อมสีแล้วจึงผ่านเข้าเครื่อง ซึ่งจะวัดความแตกต่างของการกระเจิงของแสงเลเซอร์ Johnson and Clarke (1988) พบว่าความแตกต่างของ DNA ที่เป็นองค์ประกอบของอสุจิ X และอสุจิ Y ในสัตว์เลี้ยงอยู่ในช่วง 3.5 – 4.5 เปอร์เซ็นต์ ในสุกรมีค่าเท่ากับ 3.7 เปอฺร์เซ็นต์ และสามารถแยกอสุจิแต่ละชนิดให้บริสุทธิ์ได้มากกว่า 90 เปอร์เซ็นต์ (อสุจิ X= 92.7+1.6 เปอร์เซ็นต์, อสุจิ Y = 91.2+2.6 เปอร์เซ็นต์, Mean + SEM) ถึงแม้วิธีการนี้มีความแม่นยำในการคัดแยกอสุจิ X ออกจากอสุจิ Y แต่วิธีการก็ยังซับซ้อนมากเกินไปยังไม่สามารถนำมาใช้ได้จริง ในภาคสนาม และยังพบปัญหาต่างๆ อีก เช่น มีอัตราการคัดแยกต่ำ และจำนวนของอสุจิได้หลังจากคัดแยกมีจำนวนน้อย มีราคาแพง อาจจะทำให้เกิดการผิดปกติของ DNA (Mutation) เนื่องจากอสุจิต้องผ่านแสงเลเซอร์ และต้องผ่านสารเคมีในการย้อมสีด้วย ทำให้อัตราการมีชีวิตและอัตราการผสมติดของอสุจิต่ำลงด้วย (McEvoy, 1992)
พิจารณาจากการเคลื่อนที่ของอสุจิ
จากความแตกต่างที่ว่าอสุจิ Y ว่ายเร็วกว่าอสุจิ X ทำให้มีการศึกษาการแยกอสุจิ X และอสุจิ Y โดยการเคลื่อนที่ที่แตกต่างกันการแยกอสุจิ X และ อสุจิ Y ในสารละลาย BSA(Bovine serum albumin) ด้วยวิธี Albamin gradient gradient พบว่าอสุจิ Y จะเคลื่อนที่ลงสู่ส่วนล่างของชั้น Albumin และพบอสุจิ X ลอยอยู่ในชั้นบนของ BSA อสุจิจากส่วนล่างของชั้น BSA จะแสดงลักษณะ F-body ถึง 85 เปอร์เซ็นต์ และมี อสุจิที่เคลื่อนไหวในอัตราสูง (Ericsson et al., 1973) มีการผสมเทียมในผู้หญิง โดยใช้อสุจิที่ผ่านการแยกด้วยวิธีนี้สามารถกำหนดเพศของลูกได้ 79 เปอร์เซ็นต์ โดยได้ลูกชายทั้งหมด 66 คนจากแม่ 84 คน (BeerinkandEricsson, 1982) นอกจากนี้การแยกอสุจิในของไหลด้วยวิธี Larminar flow สามารถจะทำให้อสุจิ X และ อสุจิ Y ว่ายด้วยรูปแบบที่แตกต่างกันในของเหลวที่กำลังไหลโดยอสุจิว่ายในของไหล ที่มีอัตราการไหลเปลี่ยนไปทีละน้อยแบบพาราโบลา โดยที่รูปแบบการว่ายของอสุจิทั้งหลายจะเป็นคลื่นคล้ายกันในน้ำนิ่ง แตะอสุจิ X จะเปลี่ยนเป็นรูปแบบการว่ายที่ตรงกว่าอสุจิ Y เมื่ออยู่ในของเหลวที่กำลังไหลจึงสามารถแยกออกเป็นกลุ่มที่ว่ายตรงออกมาได้ วิธีนี้สามารถแยกอสุจิ X ได้บริสุทธิ์ถึง 80 เปอร์เซ็นต์ (Sarkeret al., 1984)
พิจารณาจากคุณสมบัติ antigenic บนพื้นผิวของอสุจิ
Antigen ที่พบอยู่บนพื้นผิวของอสุจิ Y เชื่อว่าเป็นผลมาจาก Haploid expression ของโครโมโซม Y (Jeulinet al., 1983) วีธีการ H-Y antigen technique นี้อาศัยคุณสมบัติสองอย่างร่วมกันคือ อสุจิ Y มี H-Y antigen บนผนังเซลล์มากกว่าและปริมาณ DNA น้อยกว่าอสุจิ X ดังนั้นเมื่อใช้ Antibody ที่จำเพาะต่อ H-Y antigen ที่จะจับเฉพาะต่ออสุจิ Y และมีสารเรืองแสงติดอยู่ด้วย ที่จะจำเพาะจับกับ H-Yantigen ก็จะสามารถนับอสุจิที่ติดสารเรืองแสงได้โดยดูจากกล้องจุลทรรศน์ ฟลูออเรสเซนส์ (อนันต์, 2535)
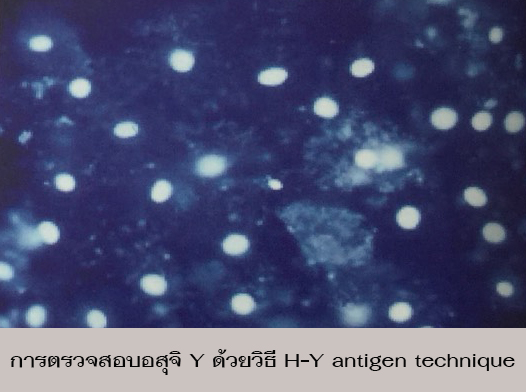
จากวิธีดังกล่าว สามารถรู้ได้แค่จำนวนของอสุจิ X หรืออสุจิ Y เท่านั้น ดังนั้นการแยกอสุจิ X และอสุจิ Y ด้วยวิธีนี้อาจจะต้องใช้เทคนิคต่อต้าน H-Yantigen ให้ไปมีผลลดจำนวนของเซลล์ที่มี H-Y antigen ทำให้อสุจิที่เหลือเป็นอสุจิ X ในเปอร์เซ็นต์ที่เพิ่มขึ้น โดยการทดลองของ Jeulinet al. (1983) พบว่าอสุจิ Y ที่อยู่ในสารละลายที่มี H-Y antibody มีจำนวนลดลงเป็น 27.1 เปอร์เซ็นต์ จาก 43.0 เปอร์เซ็นต์ และอสุจิ Y ที่มีชีวิตจะลดลงเหลือ 40.9 เปอร์เซ็นต์ จาก 64.1 เปอร์เซ็นต์
จากหนังสือเกษตรอภิรมย์ ปีที่ 4 ฉบับที่ 24 กรกฎาคม-สิงหาคม 2561 หน้า 49-52





